谢欢 谭茹月 邓晶晶
[摘要] 目的 建立采用高效液相色谱(HPLC)进行大鼠血浆中柴胡注射液有效成分柴胡皂苷d浓度测定的方法。方法 取SD雄性大鼠6只,腹腔注射柴胡注射液5 mL/kg,并在不同时间点尾静脉取血,以乙酸乙酯沉淀蛋白法处理血样,并采用HPLC法测定柴胡皂苷d的血药浓度。色谱柱为SWELL Chromplus C18(250 mm × 4 mm,5 μm),流动相为乙腈-水(梯度洗脱),紫外检测波长为204 nm,柱温:30℃,流速1 mL/min。 结果 大鼠血浆中柴胡皂苷d的线性范围为0.1~2 mg/mL(r = 0.9955);低、中、高3个浓度准确度回收率分别为92.95%、105.52%、97.86%,日内及日间精密度RSD值均<6%,检测限为2 μg/mL。低、中、高3个浓度血浆样品在室温放置12 h、-20℃冰箱冷冻保存10 d,反复冻融3次等情况下的稳定性均较好。 结论 该方法准确度高,重现性好,适用于柴胡皂苷d血药浓度的测定。
[关键词] 柴胡注射液;柴胡皂苷d;高效液相色谱法;血药浓度
[中图分类号] R969.1 [文献标识码] A [文章编号] 1673-7210(2020)05(c)-0123-04
Determination of blood concentration of active component in Bupleurum Injection
XIE Huan TAN Ruyue DENG Jingjing
School of Pharmacy, Chengdu Medical College, Sichuan Province, Chengdu 610500, China
[Abstract] Objective To establish high performance liquid chromatography (HPLC) for the determination of saikosaponin d of Bupleurum Injection in rat plasma. Methods Six SD male rats were intraperitoneally injected with Bupleurum Injection of 5 mL/kg, and the blood was collected from the tail vein at different time points. The blood samples were treated with ethyl acetate precipitated protein method, and the blood concentration of saikosaponin d was determined by HPLC. The column Swell chromplus-C18 (250 mm×4.6 mm,5 μm) was used as the column. The mobile phase was water-acetonitrile (gradient elute), the detection wavelength was 204 nm, the column temperature was 30℃ and with the flow rate of 1.0 mL/min. Results The linear range of saikosaponin d in rat plasma was 0.1-2 mg/mL (r = 0.9955). The accuracy recovery rates of low, medium and high concentrations were 92.95%, 105.52% and 97.86%, respectively. The RSD values of intra-day and intra-day precision were all < 6%, and the detection limit was 2 μg/mL. Plasma samples with low, medium and high concentrations were kept stable for 12 h at room temperature, frozen at -20℃ for 10 d, and repeatedly frozen and thawed 3 times. Conclusion The method is accurate, specific, and suitable for the determination of saikosaponin d of Bupleurum Injection in rat plasma.
[Key words] Bupleurum Injection; Saikosaponin d; High performance liquid chromatography; Plasma concentration
柴胡注射液是伞形科植物北柴胡的干燥根经水蒸气蒸馏制成的水溶液[1-2],常用于治疗流行性感冒、疟疾等疾病引起的发热[3]。随着柴胡注射液在临床上的应用日益增加,其注射后产生的神经系统反应、肝肾损伤、过敏性休克等不良反应的报道也随之增加[4-9],因此,对该药物质量控制方面的深入研究显得尤为重要。
目前对柴胡注射液的研究多为体外主要成分测定[10-13]及解热机制[14-15]等方面的内容,对其体内的血药浓度测定鲜见报道。本研究以柴胡皂苷d为检测指标,测定其血药浓度,探讨柴胡注射液中柴胡皂苷d在大鼠体内变化过程。
1 仪器与试药
1.1 仪器
Agilent1260高效液相色谱仪(美国Agilent公司);CPA225D电子天平(赛多利斯科学仪器有限公司);JPN200氮吹仪(上海继谱电子科技有限公司)。
1.2 试药
柴胡注射液(神威药业集团有限公司,规格:2 mL/支,批号:17052611、17110908、17120812);0.9%的氯化钠注射液(四川科伦药业股份有限公司,批号:L21909 0110);肝素(国药集团化学试剂有限公司,批号:2017 0426);柴胡皂苷d对照品(成都曼思特生物科技有限公司,批号:MUST-17050106,纯度:≥98%)。
1.3 动物
SPF级SD雄性大鼠,体重(200±20)g,6周龄,购自成都达硕实验动物有限公司[合格证号:SCXK(川)2018-0024]。大鼠饲养于成都医学院SPF级动物房,室内温度20~26℃,相对湿度为40%~60%。在给药前12 h开始禁食,自由饮水。
2 方法与结果
2.1 色谱条件
色谱柱:SWELL Chromplus C18(250 mm×4.6 mm,5 μm);柱温:30℃;流速:1.0 mL/min ;检测波长:204 nm;进样量:20 μL;流动相:乙腈(A)-水(B),梯度洗脱(0~5 min:5%~13%A;5~20 min:13%~16%A;20~25 min:16%~25%A;25~35 min:25%~40%A;35~40 min:40%~55%A;40~50 min:55%~65%A)。
2.2 柴胡皂苷d对照品储备液的配制
精密称取柴胡皂苷d对照品40 mg,用甲醇溶解,并定容至10 mL容量瓶中,制成4 mg/mL的柴胡皂苷d对照品贮备液,保存于-4℃冰箱中,备用。
2.3 给药方法及样品采集
SD雄性大鼠6只,体重(200±20)g,给药前12 h禁食,不禁水,腹腔注射柴胡注射液5 mL/kg,尾静脉取血0.5 mL放于肝素浸润过的EP管内,4000 r/min离心5 min,取血浆0.2 mL转移至另一EP管中,于-20℃冰箱保存,待测。
2.4 血浆样品的处理
在0.2 mL血浆样品中加入0.8 mL乙酸乙酯去蛋白,涡旋3 min,5000 r/min离心10 min,吸取上清液转移至1.5 mL EP管中,40℃氮气吹干,加入乙腈0.2 mL复溶,涡旋3 min,进行高效液相色谱(HPLC)分析,进样前用0.22 μm的微孔滤膜滤过。
2.5 方法学的验证
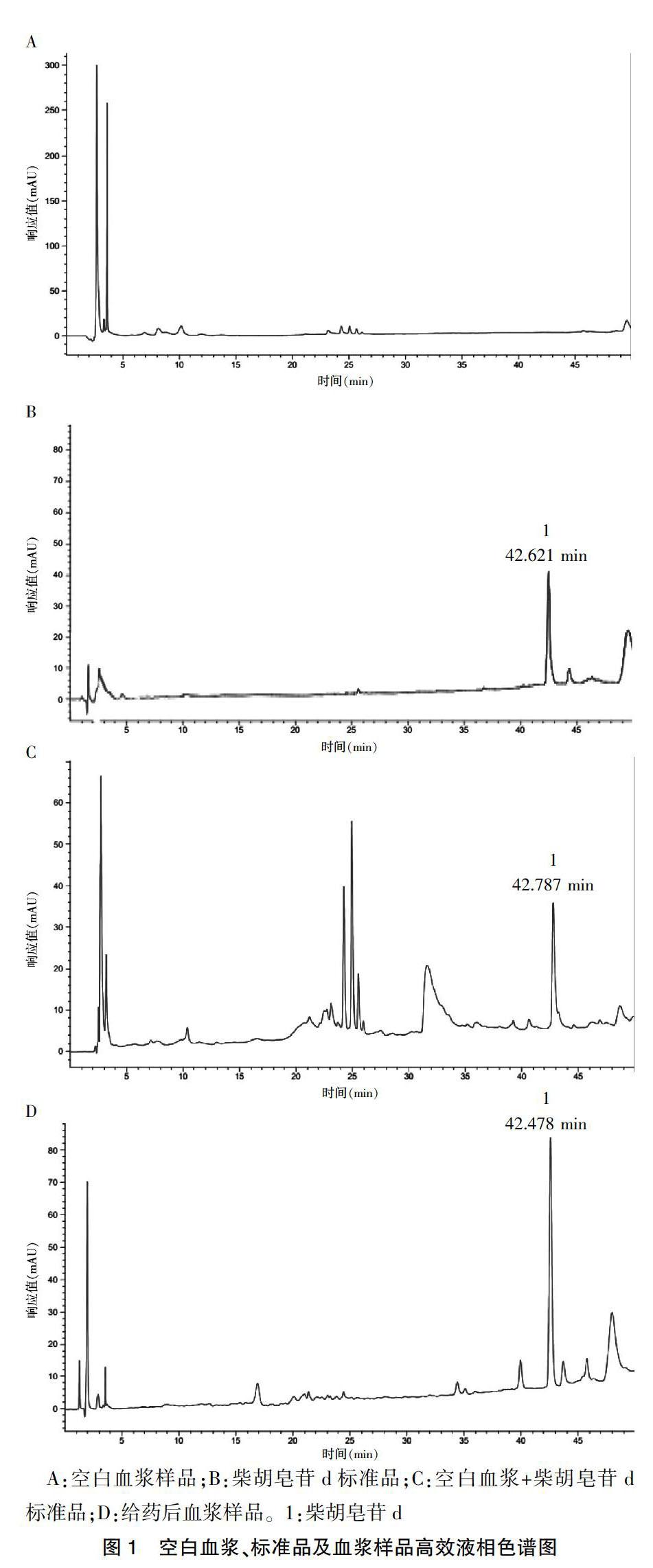
2.5.1专属性 取空白血浆样品0.5 mL,按“2.4”项下方法处理,并按“2.1”项下HPLC色谱条件测定;取“2.2”项下对照品储备液适量,用甲醇稀释至浓度为0.2 mg/mL的柴胡皂苷d标准溶液,按照“2.1”项下条件测定,柴胡皂苷d的保留时间为42.621 min;将0.2 mg/mL的柴胡皂苷d加入到0.1 mL空白血浆中,同法测定,柴胡皂苷d的保留时间为42.787 min;取大鼠给药后采集的血浆样品0.2 mL,依法操作,所得含药血浆样品柴胡皂苷d保留时间为42.478 min,对照品与含药血浆样品的色谱图中,柴胡皂苷d的色谱峰保留时间一致,同时血浆中的杂质不影响其测定。柴胡皂苷d的保留时间在42.5 min左右,其峰形良好,杂质峰影响较小。见图1。
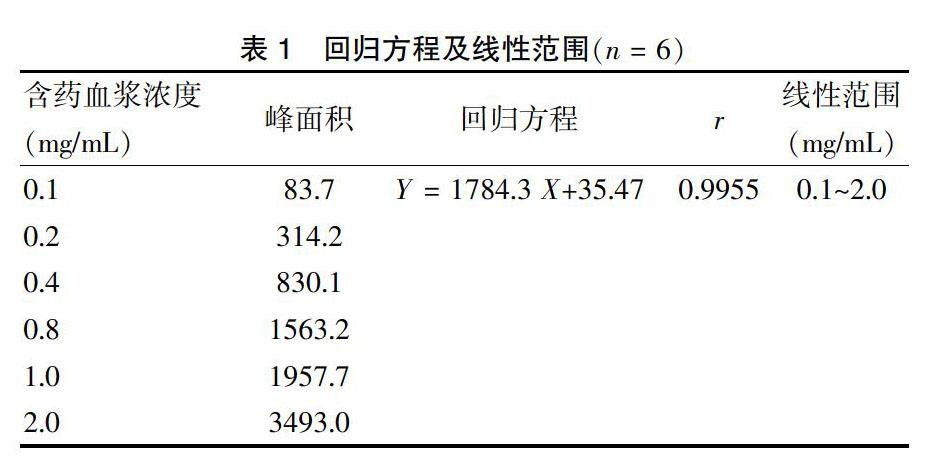
2.5.2 线性范围 精密吸取100 μL的大鼠空白血浆6份,分别依次加入“2.2”项下对照品储备液适量,按照“2.4”项下方法进行前处理,制得一系列浓度的含药血浆。随后按照“2.1”项下的条件测定。以血浆中柴胡皂苷d的浓度为横坐标,测得的峰面积为纵坐标进行线性回归,得回归方程Y = 1784.3 X+35.47(r = 0.9955),标准曲线的测定结果见表1。结果显示,在0.1~2 mg/mL的浓度范围内两者呈现良好的线性关系,r = 0.9955(n = 6),定量下限为0.1 mg/mL。
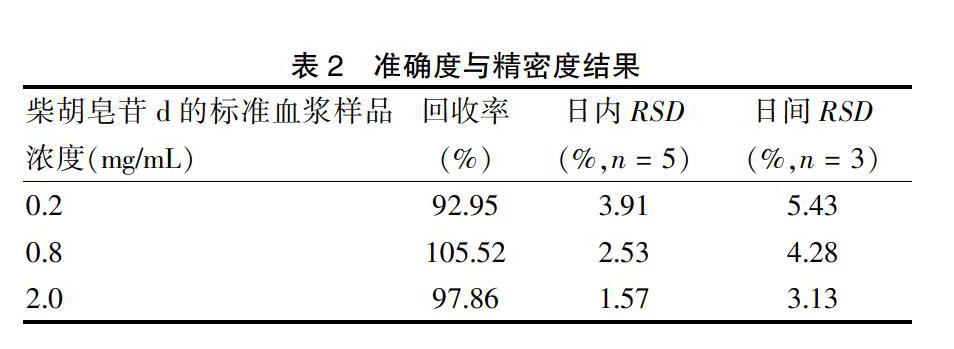
2.5.3 准确度与精密度的测定 取大鼠空白血浆100 μL,加对照品储备液分别配置低、中、高3个浓度(分别为0.2、0.8、2.0 mg/mL)的柴胡皂苷d的标准血浆样品溶液,每个浓度5份样品,按“2.4”项下方法处理后再按“2.1”项下条件进行测定,记录峰面积。连续测定3 d,根据当日的标准曲线,计算出柴胡皂苷d的浓度,并考察方法的准确度、日内精密度及日间精密度,见表2。结果显示该方法的准确度、日内精密度及日间精密度均符合方法学验证要求。
2.5.4 提取回收率测定与检测限的测定 取大鼠空白血浆100 μL,加入对照品储备液分别配制成“2.5.3”项下低、中、高3种浓度的血浆样品,每个浓度5份样品,按“2.4”项下方法处理后再按“2.1”项下条件进行测定,记录峰面积为A。另取空白血浆,按“2.4”项下方法处理后,分别加入低、中、高3种浓度的柴胡皂苷d对照品溶液,按“2.1”项下色谱条件进行测定,记录峰面积为B。按A/B×100%计算柴胡皂苷d低、中、高3种浓度的提取回收率分别为75.64%、82.31%、88.97%,各浓度水平的RSD≤6.43%(n = 5)。以1 mg/mL柴胡皂苷d标准溶液为基础无限稀释数倍,同法测定记录峰面积,以信噪比等于3时对应的血浆中的柴胡皂苷d的浓度为本方法的检测限,结果显示,大鼠血浆中柴胡皂苷d经本法测定的的检测限为2 μg/mL。
2.5.5 稳定性考察 取大鼠空白血浆100 μL,加对照品储备液分别配置成如上低、中、高3个浓度的柴胡皂苷d的标准血浆样品溶液,每个浓度5份样品,按“2.4”项下方法处理后再按“2.1”项下条件进行测定,记录峰面积。分别考察含药血浆在室温放置8 h(0、2、4、6、8 h)、-20℃冰箱冷冻保存10 d,反复冻融3次等情况下对稳定性的影响,见表3,结果显示该方法在上述条件下稳定性良好。
2.6 血浆样品中柴胡皂苷d含量的测定
取大鼠血浆样品按“2.4”项下方法处理后再按“2.1”项下条件进行测定,记录峰面积并计算血药浓度,30 min时的血药浓度为0.637 mg/mL,45 min时的血药浓度为0.852 mg/mL,75 min时的血药浓度为1.884 mg/mL,120 min时的血药浓度为0.680 mg/mL,150 min时的血药浓度为0.549 mg/mL。
3 讨论
确定给药剂量时,按照人与大鼠间体表面积折算的等效剂量比值所得,普通成人体内注射剂量为4 mL,推算大鼠注射剂量应为0.024 mL,但实验结果显示此剂量在腹腔注射时浓度过低,且取样量太小不易于操作,故查阅相关文献[1,10]后并结合预实验结果,腹腔注射的用药剂量为5 mL/kg。
在血浆样品前处理时,本研究尝试了采用乙腈和乙酸乙酯分别沉淀蛋白,结果显示,乙腈沉淀蛋白后的血浆样品有较多的白色不溶性杂质,且色谱图上杂质峰较多;采用等量乙酸乙酯沉淀蛋白后几乎未见杂质的沉积,且色谱图上杂质峰也相对较少,故本研究最终采用乙酸乙酯沉淀蛋白。
在HPLC确定检测波长时,根据文献[16-20],204、208 nm和210 nm都可作为柴胡皂苷d的测定波长。本研究在对柴胡皂苷d标准品进行紫外扫描时,结果显示204、208、210、278 nm处均有吸收,其中204 nm处吸光度最大,且无其他色谱峰干扰。以278 nm作为检测波长时,血浆样品测定结果显示无明显吸收;以208、210 nm作为检测波长时,血浆样品溶液和体外标准品溶液的测定图谱显示柴胡皂苷d吸收峰均不及204 nm时测定的高,故最终选择204 nm作为检测波长。
本研究采用HPLC法建立了在大鼠血浆样品中柴胡注射液的柴胡皂苷d含量的测定方法,结果显示该法回收率高,重复性和稳定性好,后续可用于柴胡注射液中柴胡皂苷d的药动学研究。
[参考文献]
[1] 苏春萌,唐嘉熙,罗阳,等.柴胡注射液解热作用的谱-效关系研究[J].中国药房,2016,27(10):1340-1343.
[2] 徐男,孙蓉,李晓宇,等.基于“效-毒”相关模式的柴胡注射液质量研究与思考[J].中国药物警戒,2015,19(4):200-202.
[3] 赵望森,张业聪,武梦蝶.柴胡注射液配合奥司他韦治疗流感样症状的临床疗效分析[J].系统医学,2017,2(20):34-36.
[4] 康新奇.柴胡注射液的药理及不良反应分析[J].中国现代药物应用,2015,34(9):750-751.
[5] 王长之.531例柴胡注射液不良反应/事件报告分析[J].海峡药学,2018,30(8):279-282.
[6] 陈素霞,彭肖欢,罗宇娟.安痛定联用柴胡注射液致晕厥的护理及预防[J].海峡药学,2016,4(7):219-220.
[7] 刘旭,刘振华,仲华,等.柴胡注射液致药品不良反应/药品不良事件的分析及防治[J].中国医院用药评价与分析,2018,33(6):840-843.
[8] 于红权.柴胡注射液的药理及不良反应分析[J].临床医药文献电子杂志,2016,3(1):167-168.
[9] 张雷.柴胡注射液过敏性休克18例回顾性分析[J].中国基层医药,2017,24(18):2776-2779.
[10] 陈文露,彭新宇,余静贤,等.不同制备工艺柴胡注射液成分分析及质量标准探讨[J].中成药,2019,28(4):895-901.
[11] 程玉鹏,马爱萍,陈琦,等.RP-HPLC法测定柴胡中角鲨烯含量[J].辽宁中医药大学学报,2017,19(1):61-63.
[12] 徐男,孙蓉,李晓宇,等.基于“效-毒”相关模式的柴胡注射液质量研究与思考[J].中国药物警戒,2015,12(4):200-203.
[13] 姜国志,郝鹏彬,王文鹏,等.不同药用部位及制备工艺对柴胡注射液质量的影响[J].中国实验方剂学杂志,2016, 22(6):5-7.
[14] 左泽平,王志斌,高阳,等.柴胡注射液对LPS发热大鼠解热机制的研究[J].中药药理与临床,2012,28(4):57-60.
[15] 石亮,张智慧,李晓宇,等.柴胡水提物对大鼠解热作用机制研究[J].中国药物警戒,2016,13(9):513-516.
[16] 胡轶娟,浦锦宝,梁卫青,等.柴胡提取物中柴胡皂苷d及总皂苷的含量测定[J].中国中医药科技,2011,18(1):46-47.
[17] 赵晓丽.UHPLC法测定柴黄片中柴胡皂苷a和柴胡皂苷d含量探讨[J].首都食品与医药,2017,24(14):98-99.
[18] 田静,王晓梅,胡勤.HPLC法测定近视康合剂中柴胡皂苷d的含量[J].中医药导报,2010,16(11):82-83.
[19] 闫婕,卫莹芳,古锐,等.HPLC测定4种川产柴胡地上与地下部分柴胡皂a,c,d的含量[J].中国实验方剂学杂志杂志,2014,20(13):73-76.
[20] 孟杰,陈兴福,杨文钰,等.柴胡主根与侧根中柴胡皂苷a及皂苷d含量测定[J].药物分析杂志,2013,33(7):1218-1222.
(收稿日期:2019-10-11 本文编辑:刘永巧)



